【2022年四川省达州市中考化学试卷】-第1页
试卷格式:2022年四川省达州市中考化学试卷.pdf
试卷热词:最新试卷、2022年、四川试卷、达州市试卷、化学试卷、九年级试卷、中考试卷、初中试卷

扫码查看解析
试卷题目
1.下列具有达州特色的农副产品的加工过程,主要发生化学变化的是( )
- a. 酿“苞谷烧”酒
- b. 编制竹篓
- c. 采摘“巴山雀舌”茶
- d. 包装“灯影牛肉”
2.正确的实验操作是化学实验成功的重要保证。下列实验操作正确的是( )
- a.

滴加液体 - b.
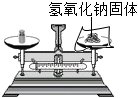
称取8.0g氢氧化钠固体 - c.

测定溶液的ph - d.
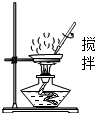
蒸发氯化钠溶液
3.蓝莓富含花青素(c15h11o6)。花青素是一种水溶性色素,颜色与细胞液的酸碱性有关,酸性时为红色,碱性时为蓝色。下列有关说法正确的是( )
- a. 花青素是有机物
- b. 花青素中碳、氢、氧的质量比为15:11:6
- c. 花青素由碳原子、氢原子、氧原子构成
- d. 在氢氧化钠溶液中滴入蓝莓汁液,溶液呈红色
4.化学与我们的生产生活息息相关。下列说法不正确的是( )
- a. 碘是人体所需要的一种微量元素,缺碘会导致甲状腺肿大
- b. 纸箱着火用水浇灭,降低了可燃物的着火点
- c. 洗涤剂具有乳化作用,能用于清洗油污
- d. 鉴别聚酯纤维和羊毛可用灼烧闻气味的方法
5.甲醛(ch2o)是一种有毒气体,房屋装修时部分建材释放出的甲醛严重影响人体健康。科学家们研究发现,使用特殊的催化剂可高效地促进甲醛的转化,从而降低甲醛的危害。其反应过程的微观示意图如图,下列说法不正确的是( )
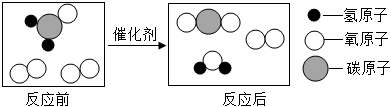

- a. 参加反应的两种物质的微粒个数比为1:2
- b. 该反应一定有元素的化合价发生变化
- c. 反应前后原子的种类、数目不变
- d. 反应前后分子的种类改变
6.t1℃时,将相同质量的kno3和kcl分别加入到盛有100g水的甲、乙烧杯中,充分搅拌后现象如图ⅰ所示,图ⅱ为两物质的溶解度曲线。以下说法正确的是( )
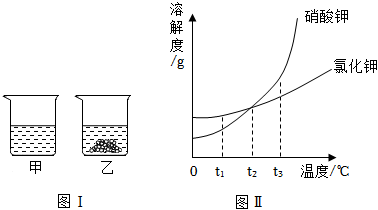

- a. 甲烧杯中的溶质为kno3
- b. 将温度升高到t2℃时,乙烧杯中仍然有固体剩余
- c. 若kno3中混有少量kcl,可采用蒸发结晶的方法提纯kno3
- d. 若取t3℃时kno3和kcl的饱和溶液各100g,降温至t2℃,析出晶体较多的是kno3
7.下列图像分别与选项中的操作相对应,合理的是( )
- a.
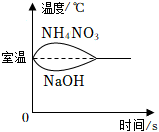
向等质量的水中分别加入相同质量的氢氧化钠固体和硝酸铵固体 - b.
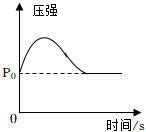
在盛有空气的密闭容器中点燃红磷 - c.
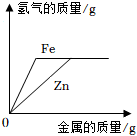
向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉 - d.
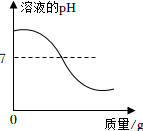
向一定质量的稀盐酸中不断加入氢氧化钠溶液
8.勤劳智慧的中国劳动人民在很早以前就掌握了湿法炼铜的技术。某实验小组模拟湿法炼铜,向50.0gcuso4溶液中加入10.0g铁粉(铁粉过量),待溶液中cuso4反应完全后,过滤,所得滤渣的质量为10.4g。则原溶液中cuso4的质量分数为( )
- a. 20%
- b. 16%
- c. 10%
- d. 8%
9.化学用语是学习和研究化学的基础。请用适当的化学用语填空。
(1)通常状况下,密度最小的气体是 。
(2)两个氢氧根离子 。
(3)五氧化二磷中磷元素的化合价 。
(1)通常状况下,密度最小的气体是 。
(2)两个氢氧根离子 。
(3)五氧化二磷中磷元素的化合价 。
10.为打造成渝地区双城经济圈北翼振兴战略支点,达州市在打造能源化工、新材料、农产品加工3个千亿级产业带的同时,也要积极打好“蓝天、碧水、净土”保卫战。
(1)为建成全国性综合交通枢纽城市,达州市大力实施“经济发展、交通先行”战略,在基础设施建设中选择应用新材料。达州新建机场——金垭机场使用了大量玻璃钢材料,玻璃钢是一种 (填字母序号)。
a.复合材料
b.无机非金属材料
c.合成材料
(2)自2013年以来,达州以水稻、油菜、玉米、薯类等为重点,建设“川渝粮仓”,粮食总产量连续9年保持在六十亿斤以上,稳居全省第一。
①大米、玉米、薯类中主要富含的营养素是 (填字母序号)。
a.蛋白质
b.油脂
c.糖类
d.维生素
②抓三农促振兴,坚定建设农业强市。2022年,我市规划大豆种植须达到53.5万亩。正所谓:“庄稼一枝花,全靠肥当家”。大豆等农作物生长期间常需施加一些肥料。下列属于复合肥料的是 (填字母序号)。
a.co(nh2)2
b.nh4h2po4
c.k2so4
(3)2021年3月全国两会期间提出,2030年“碳达峰”,2060年“碳中和”。实现“碳达峰”“碳中和”需控制二氧化碳的排放量。请写出一条生活中践行“低碳”生活的具体做法: 。
(4)“碧水”就得保护好水资源。下列关于水资源保护的做法正确的是 (填字母序号)。
a.为了改善水质,向其中加入大量的净水剂和消毒剂
b.为保护好水资源,禁止使用化肥和农药
c.大量开采利用地下水
d.工业废水处理达标后再排放
(1)为建成全国性综合交通枢纽城市,达州市大力实施“经济发展、交通先行”战略,在基础设施建设中选择应用新材料。达州新建机场——金垭机场使用了大量玻璃钢材料,玻璃钢是一种 (填字母序号)。
a.复合材料
b.无机非金属材料
c.合成材料
(2)自2013年以来,达州以水稻、油菜、玉米、薯类等为重点,建设“川渝粮仓”,粮食总产量连续9年保持在六十亿斤以上,稳居全省第一。
①大米、玉米、薯类中主要富含的营养素是 (填字母序号)。
a.蛋白质
b.油脂
c.糖类
d.维生素
②抓三农促振兴,坚定建设农业强市。2022年,我市规划大豆种植须达到53.5万亩。正所谓:“庄稼一枝花,全靠肥当家”。大豆等农作物生长期间常需施加一些肥料。下列属于复合肥料的是 (填字母序号)。
a.co(nh2)2
b.nh4h2po4
c.k2so4
(3)2021年3月全国两会期间提出,2030年“碳达峰”,2060年“碳中和”。实现“碳达峰”“碳中和”需控制二氧化碳的排放量。请写出一条生活中践行“低碳”生活的具体做法: 。
(4)“碧水”就得保护好水资源。下列关于水资源保护的做法正确的是 (填字母序号)。
a.为了改善水质,向其中加入大量的净水剂和消毒剂
b.为保护好水资源,禁止使用化肥和农药
c.大量开采利用地下水
d.工业废水处理达标后再排放
11.化学是在原子、分子水平上研究物质及其变化规律的一门基础学科。
(1)图ⅰ是五种微粒的结构示意图。
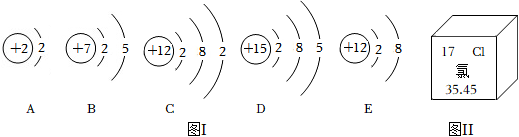
①上述微粒共表示 种元素。
②上述五种微粒中,化学性质相似的两种原子是 (填字母序号)。
(2)元素周期表是学习化学的重要工具。由图ⅱ知,氯元素的相对原子质量为 。
(1)图ⅰ是五种微粒的结构示意图。

①上述微粒共表示 种元素。
②上述五种微粒中,化学性质相似的两种原子是 (填字母序号)。
(2)元素周期表是学习化学的重要工具。由图ⅱ知,氯元素的相对原子质量为 。
12.在实验操作考试中,小明的考试题目是配制50g溶质质量分数为6%的nacl溶液(已知ρ水=1g/ml),请回答下列问题:
(1)小明应称取nacl固体 g。在称量的过程中,发现托盘天平的指针向左偏转,此时小明应该 (填字母序号)。
a.增加适量nacl
b.减少适量nacl
c.增加砝码
d.调节天平平衡螺母
(2)量取蒸馏水时,小明应选择 (填“20ml”或“50ml”或“100ml”)的量筒。
(3)下列因素会造成小明所配溶液溶质质量分数偏小的是 (填字母序号)。
a.量取蒸馏水时仰视读数
b.量取蒸馏水时俯视读数
c.将称量好的nacl固体转移至烧杯时,nacl洒落
d.配好的溶液转移到试剂瓶时,部分溶液溅出
(1)小明应称取nacl固体 g。在称量的过程中,发现托盘天平的指针向左偏转,此时小明应该 (填字母序号)。
a.增加适量nacl
b.减少适量nacl
c.增加砝码
d.调节天平平衡螺母
(2)量取蒸馏水时,小明应选择 (填“20ml”或“50ml”或“100ml”)的量筒。
(3)下列因素会造成小明所配溶液溶质质量分数偏小的是 (填字母序号)。
a.量取蒸馏水时仰视读数
b.量取蒸馏水时俯视读数
c.将称量好的nacl固体转移至烧杯时,nacl洒落
d.配好的溶液转移到试剂瓶时,部分溶液溅出
13.已知a、b、c、d、e为初中化学中常见的五种不同类别的物质,b为红棕色粉末,c由两种元素组成,d广泛应用于冶金、造纸、纺织、印染和洗涤剂生产等领域,五种物质的转化关系如图所示(“一”表示相连的两种物质能发生反应,“→”表示相连物质能向箭头所指一方转化)。部分反应物、生成物及反应条件已省略。请回答下列问题:
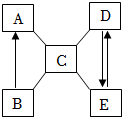
(1)b物质的化学式为 。
(2)a和c反应的化学方程式为 。
(3)c和e反应的实质为 。

(1)b物质的化学式为 。
(2)a和c反应的化学方程式为 。
(3)c和e反应的实质为 。
14.海洋是一个巨大的资源宝库。海水资源综合利用的部分途径如图:
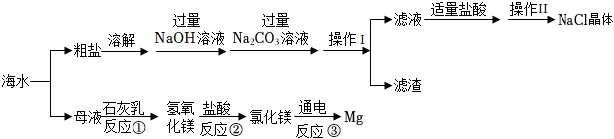
已知:粗盐中的杂质有泥沙、mgcl2、cacl2,流程中部分操作及试剂已省略。
(1)“操作ⅰ”中玻璃棒的作用是 。
(2)滤渣中除泥沙外还有 (填化学式)。
(3)反应③的化学反应方程式为 。
(4)海水中本身就有氯化镁,请分析反应①、②转化过程的目的 。

已知:粗盐中的杂质有泥沙、mgcl2、cacl2,流程中部分操作及试剂已省略。
(1)“操作ⅰ”中玻璃棒的作用是 。
(2)滤渣中除泥沙外还有 (填化学式)。
(3)反应③的化学反应方程式为 。
(4)海水中本身就有氯化镁,请分析反应①、②转化过程的目的 。
15.钢铁是应用最普遍的金属材料,也是最容易发生锈蚀的金属材料之一。人类为金属的锈蚀付出了巨大的代价,所以金属的防腐和废旧金属的回收有着十分重要的意义。
(1)工业上用赤铁矿(主要成分fe2o3)炼铁的原理: (用化学方程式表示)。
(2)钢铁生锈是铁与空气中 发生化学反应的结果。
(3)处理某废旧金属后的溶液中含有cu(no3)2和agno3两种溶质,为回收其中的金属,向该溶液中加入一定量的铁粉,充分反应后过滤,再向滤渣中加入稀盐酸,无气泡产生。则滤液中一定含有的金属离子是 ;滤渣中可能含有 。
(1)工业上用赤铁矿(主要成分fe2o3)炼铁的原理: (用化学方程式表示)。
(2)钢铁生锈是铁与空气中 发生化学反应的结果。
(3)处理某废旧金属后的溶液中含有cu(no3)2和agno3两种溶质,为回收其中的金属,向该溶液中加入一定量的铁粉,充分反应后过滤,再向滤渣中加入稀盐酸,无气泡产生。则滤液中一定含有的金属离子是 ;滤渣中可能含有 。
16.化学是一门以实验为基础的自然科学。结合下列实验装置图回答有关问题。
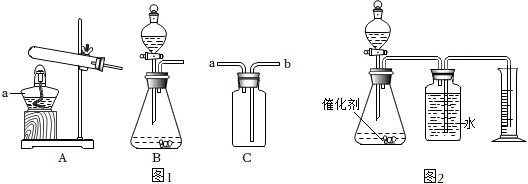
(1)a装置中仪器a的名称是 。
(2)通常状况下,h2s是一种密度比空气大、有臭鸡蛋气味的有毒气体,能溶于水。实验室用块状的硫化亚铁与稀硫酸发生复分解反应制取硫化氢气体。
①制取h2s气体的发生装置可选用 (填字母序号)。
②若用c装置来收集h2s,气体应从 端(填a或b)进入集气瓶。
(3)某化学兴趣小组用图2装置探究mno2、cuo对过氧化氢分解的催化效果,设计的方案和记录的数据如表所示:
①表格中a的值为 。
②实验1中制取氧气的化学反应方程式为 。
③结论:mno2对过氧化氢分解的催化效果比cuo好,得出该结论的依据是 。

(1)a装置中仪器a的名称是 。
(2)通常状况下,h2s是一种密度比空气大、有臭鸡蛋气味的有毒气体,能溶于水。实验室用块状的硫化亚铁与稀硫酸发生复分解反应制取硫化氢气体。
①制取h2s气体的发生装置可选用 (填字母序号)。
②若用c装置来收集h2s,气体应从 端(填a或b)进入集气瓶。
(3)某化学兴趣小组用图2装置探究mno2、cuo对过氧化氢分解的催化效果,设计的方案和记录的数据如表所示:
| 实验序号 | 过氧化氢溶液 | 催化剂 | 收集50mlo2所用时间 |
| 实验1 | 30ml2% | 粉末状mno2 0.2g | 21s |
| 实验2 | 30ml2% | 粉末状cuo ag | 47s |
①表格中a的值为 。
②实验1中制取氧气的化学反应方程式为 。
③结论:mno2对过氧化氢分解的催化效果比cuo好,得出该结论的依据是 。
17.我国化学家侯德榜创立的侯氏制碱法,为世界制碱工业作出了突出贡献。在工业生产所得的碳酸钠产品中往往会混有少量的氯化钠。某校化学兴趣小组同学想探究某产品中碳酸钠的质量分数,经讨论后设计了如下两种实验方案。
【查阅资料】碱石灰的主要成分是cao和naoh。
【设计与实验】
方案甲:“气体质量法”
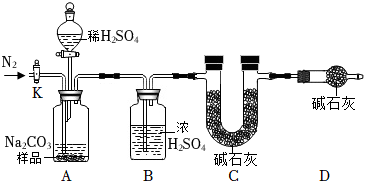
①按如图所示连接好装置,检查装置气密性后加入一定质量的碳酸钠样品于装置a中。
②打开止水夹k通入一段时间的氮气后,称量装置c的质量,并记录。
③关闭止水夹k,打开分液漏斗活塞向a装置中注入足量的稀硫酸,关闭活塞。
④待装置a中无气泡产生后打开止水夹k,再次通入氮气一段时间后,关闭止水夹k,第二次称量装置c的质量,并记录。
⑤计算。
【分析与讨论】
(1)装置a中发生反应的化学方程式为 。
(2)装置b中浓硫酸的作用是 。
(3)步骤④中再次通入氮气的目的是 。
(4)装置d的作用是 。
方案乙:“沉淀质量法”
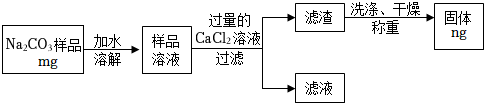
(5)写出上述流程中相关反应的化学方程式: 。
【得出结论】
同学们经过实验,最终都计算出了样品中碳酸钠的质量分数。
(6)请你根据方案乙中测定的相关数据,求出样品中碳酸钠的质量分数为 ×100%(用含有m、n的代数式表示)。
(7)【反思与交流】
同学们经过讨论认为方案乙优于方案甲,理由主要是 (填字母序号)。
a.节约能源
b.操作简便
c.保护环境
【查阅资料】碱石灰的主要成分是cao和naoh。
【设计与实验】
方案甲:“气体质量法”

①按如图所示连接好装置,检查装置气密性后加入一定质量的碳酸钠样品于装置a中。
②打开止水夹k通入一段时间的氮气后,称量装置c的质量,并记录。
③关闭止水夹k,打开分液漏斗活塞向a装置中注入足量的稀硫酸,关闭活塞。
④待装置a中无气泡产生后打开止水夹k,再次通入氮气一段时间后,关闭止水夹k,第二次称量装置c的质量,并记录。
⑤计算。
【分析与讨论】
(1)装置a中发生反应的化学方程式为 。
(2)装置b中浓硫酸的作用是 。
(3)步骤④中再次通入氮气的目的是 。
(4)装置d的作用是 。
方案乙:“沉淀质量法”

(5)写出上述流程中相关反应的化学方程式: 。
【得出结论】
同学们经过实验,最终都计算出了样品中碳酸钠的质量分数。
(6)请你根据方案乙中测定的相关数据,求出样品中碳酸钠的质量分数为 ×100%(用含有m、n的代数式表示)。
(7)【反思与交流】
同学们经过讨论认为方案乙优于方案甲,理由主要是 (填字母序号)。
a.节约能源
b.操作简便
c.保护环境
18.某厂生产的nacl样品中含有少量mgcl2杂质。该厂质检员称取20g该样品,完全溶解在100g蒸馏水中,向所得溶液中加入氢氧化钠溶液,产生沉淀的质量与所加氢氧化钠溶液的质量关系如图所示,请回答:
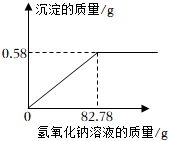
(1)样品中mgcl2的质量为 g。
(2)计算恰好完全反应时,溶液中溶质的质量分数。(写出计算过程)

(1)样品中mgcl2的质量为 g。
(2)计算恰好完全反应时,溶液中溶质的质量分数。(写出计算过程)
查看全部题目